MammaTyper®
Sous-typage moléculaire complet des patients atteints de cancer du sein
- Détermination précise du statut HER2, ER, PR et Ki-67 en un seul test
- Sous-typage définitif du cancer du sein pour des décisions thérapeutiques fiables
- Test quantitatif non subjectif et facile à utiliser
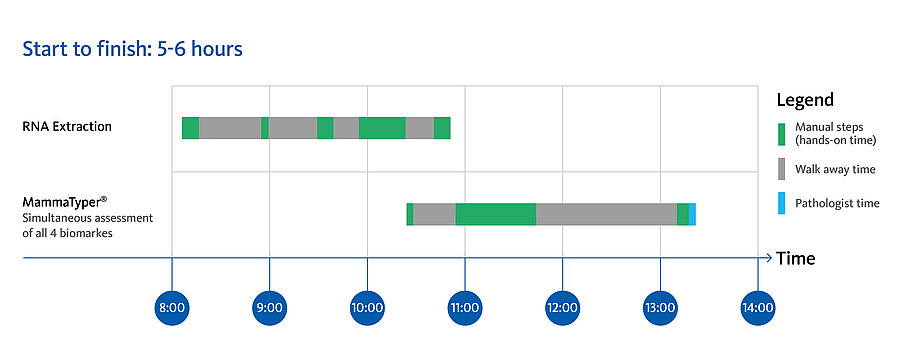
- Temps de traitement réduit et résultats le jour même
- Test RT-qPCR IVD marqué CE pour les cycleurs les plus communément utilisés
MammaTyper® quantifie avec précision l’expression des ARNm de HER2, ER, PR et Ki-67
MammaTyper® est un test de diagnostic moléculaire permettant la détermination quantitative des quatre biomarqueurs clés utilisés dans le sous-typage du cancer du sein.
Le récepteur 2 du facteur de croissance épidermique humain (HER2), le récepteur des œstrogènes (ER), le récepteur de la progestérone (PR) et le marqueur de prolifération Ki-67 sont des biomarqueurs fondamentaux dans l’évaluation des tumeurs cancéreuses du sein.
La combinaison des résultats des biomarqueurs permet d’évaluer les différents sous-types de cancer du sein selon le consensus de Saint Gall, ce qui est essentiel pour les décisions thérapeutiques.
Définition des sous-types de substitution du cancer du sein (Saint-Gall 2013)
| Sous-types de cancer du sein | ER | PR | HER2 | Ki-67 |
| Luminal A-like | Pos | Pos | Nég | Nég |
| Luminal B-like (HER2 négatif) | Pos | Pos/Nég* | Nég | Pos/Nég* |
| Luminal B-like (HER2 positif) | Pos | Pos/Nég | Pos | Pos/Nég |
| HER2 positif (non luminal) | Nég | Nég | Pos | Pos/Nég |
| Triple négatif (canalaire) | Nég | Nég | Nég | Pos/Nég |
*à l’exception de la combinaison PR positif et Ki-67 négatif = luminal A-like
MammaTyper® est conçu pour répondre au besoin de sous-typage moléculaire rapide, quantitatif et standardisé permettant de prendre des décisions thérapeutiques fiables.
MammaTyper® est un test facile à utiliser pour tout laboratoire de pathologie, offrant des résultats précis en 6 heures.
| 1 | Préparation d’échantillon | Section de tissu FFPE de 10 μm (teneur en cellules tumorales > 20 %). |
| 2 | Extraction de l’ARN | L’utilisation du kit d’extraction d’ARN à partir d’échantillons FFPE conformément au mode d’emploi ou de systèmes d’extraction de l'ARN validés commercialement disponibles est recommandée. |
| 3 | Mise en place du test MammaTyper® | Préparation des mastermix et répartition sur la plaque à 96 puits. Permet d’analyser simultanément jusqu’à 8 échantillons des patients. |
| 4 | Analyse RT-qPCR | Validée sur les instruments qPCR suivants :
SLAN®-96P Real-Time PCR System (Sanure Biotech) |
| 5 | Traitement des données et création de rapports | Logiciel pratique de génération de rapports MammaTyper® Report Generator :
|
MammaTyper® est une marque déposée dans différentes juridictions, exclusivement sous licence de Cerca Biotech www.cercabiotech.com
| Feature | MammaTyper® IVD test kit (10 reactions) |
| Sample type | 10 μm FFPE tissue section (tumor cell content > 20 %) |
| Sample capacity | Up to 8 patient samples per kit |
| QC function | 2 external controls (positive + negative) |
| Compatiple platforms | LightCycler® 480 Instrument II (Roche) Cobas z® 480 Analyzer (Roche) Versant® kPCR AD module (Siemens) Applied Biosystems® 7500 Fast (Dx) RT PCR (ThermoFisher Scientific) CFX96TM RT PCR Detection System-IVD (BIO-RAD®) MX3000P (Agilent®) Agilent® AriaDx Real-Time PCR System (Agilent®) SLAN®-96P Real-Time PCR System (Sanure Biotech) |
| Concordance | Concordance between MammaTyper® and IHC/CISH-based biomarker assessments: HER2 91.8%, ER 91.8%, PR 82.5%, KI67 75.0% 1 Overall Percentage Agreement (OPA) of assessment by MammaTyper® vs IHC/FISH (Ki67 digital image analysis): HER2 95.0%, ER 95.5%, PR 89,4%, Ki67 87,2% 4 |
| Reproducibility | Reproducibility of binary single-marker results (pos/neg), as well as the molecular subtype agreement, was almost perfect (kappa values: 0,90 – 1,00) in a 10 centre concordance study 2 |
| Reclassification | MammaTyper® may offer more precise assessment of endocrine responsiveness, improve Ki67 standardization and help resolve eqivocal HER2 IHC/FISH cases, leading to potential redistributions of the molecular subtypes 3 |
| Catalogue Number | CC01010 |
Références
- Wirtz RM et al., Breast Cancer Res Treat 2016; 157(3), 437446
- Varga Z et al., Breast Cancer Res 2017; 19(55), 1-13
- Caselli E et al., PLOS ONE 2021; 16(9), 1-18
- Shaaban A et al., Eur J Cancer 2022; 175(1), 87-88
Sysmex France
Sysmex France
ZAC Paris Nord 2
93420 Villepinte
01 48 17 01 90
Documents produit
Documents réglementaires
Les documents réglementaires tels que la Notice d’utilisation sont accessibles à l’aide d’un login My Sysmex valide :
Vers My Sysmex![[.FR-fr France (french)] MammaTyper Box](/fileadmin/_processed_/a/d/csm_MammaTyper_3_b15f9fc541.png)
![[.FR-fr France (french)] MammaTyper Vials](/fileadmin/_processed_/6/8/csm_MammaTyper_2_022fedd638.png)

![[.FR-fr France (french)] MammaTyper Box](/fileadmin/media/f100/Products/MammaTyper_3.png)
![[.FR-fr France (french)] MammaTyper Vials](/fileadmin/media/f100/Products/MammaTyper_2.png)