Calendrier Scientifique Septembre 2023
Identification d'une LLC typique au moyen de deux technologies complémentaires
Comment les différentes techniques permettent-elles l’identification des lymphocytes anormaux ?
En fonction de leur teneur en ARN/ADN dans les canaux WDF et WPC de la série XN
En détectant un phénotype lymphocytaire anormal à l'aide de l'immunophénotypage par cytométrie en flux
En se fondant sur des caractéristiques morphologiques telles qu’un ratio NC élevé, un noyau ovale, et une chromatine nucléaire hétérogène et agglomérée
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Contexte d’un cas
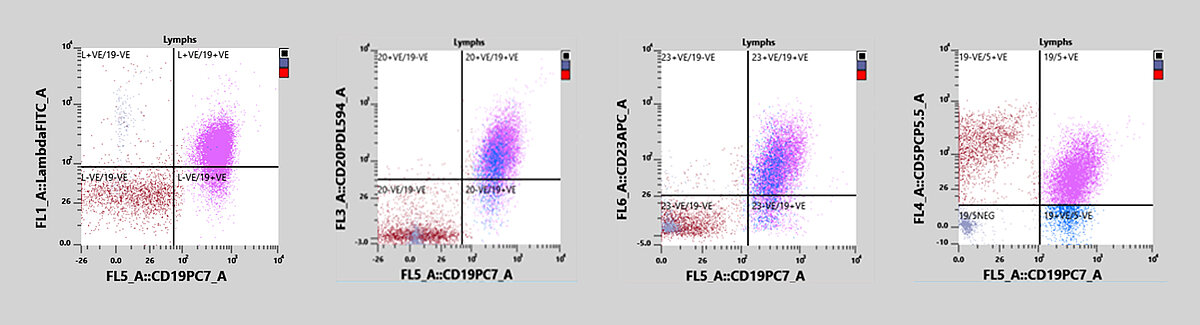
Un patient a consulté son médecin généraliste car il ne se sentait pas bien. Un échantillon de sang périphérique a été prélevé et envoyé au laboratoire. L'analyse initiale à l’aide d’un XN-20 a montré un taux plaquettaire normal excluant toute anémie, mais il a révélé une lymphocytose avec présence de cellules potentiellement malignes. Le médecin a envoyé l'échantillon au laboratoire de cytométrie en flux en vue de procéder à une analyse par immunophénotypage. L'échantillon, mesuré sur un analyseur XF-1600, s’est avéré positif à CD19, CD5, CD20, CD23, CD79b et a montré une prolifération monoclonale de la chaîne légère lambda.
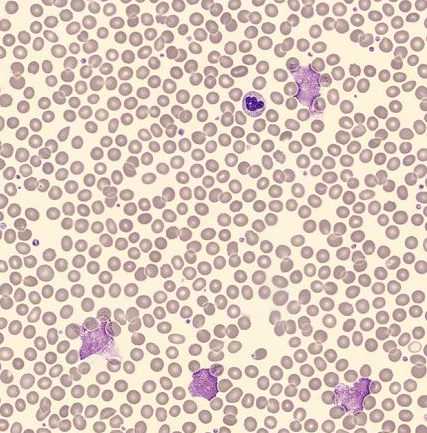
De plus, un frottis sanguin a été effectué et analysé à l'aide de l'analyseur d'imagerie numérique automatisé DI-60. L'examen du frottis a révélé de petits lymphocytes présentant un rapport noyau-cytoplasme élevé et un motif nucléaire à chromatine condensée. Des cellules de frottis, typiquement observées chez les patients atteints de leucémie lymphoïde chronique, étaient également présentes [6].
Scattergramme et interprétation morphologique
L'analyse morphologique à l'aide d'un analyseur d'imagerie numérique automatisé DI-60 a révélé la présence de cellules de frottis.
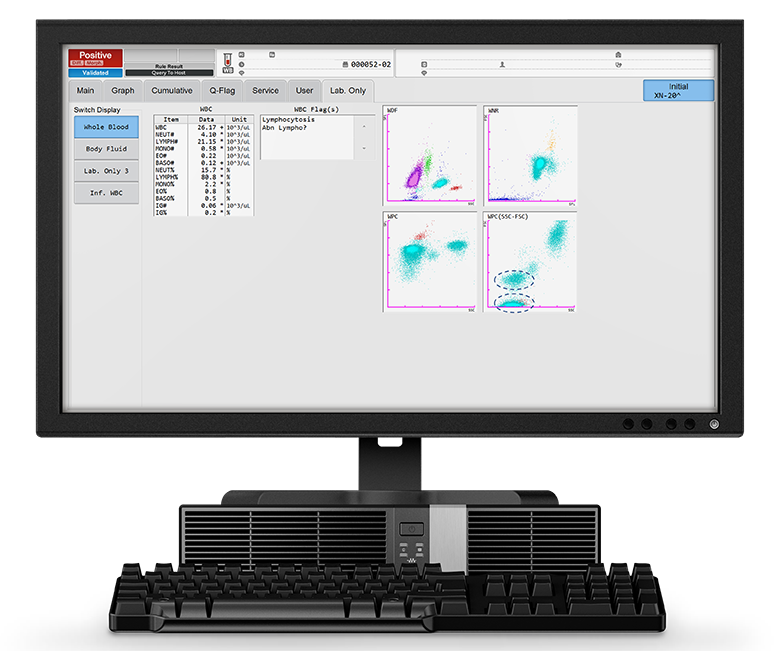
L'analyse sanguine du patient a révélé forte augmentation de la numération des globules blancs à hauteur de 26,17 x 103/µL, dont 80 % étaient des lymphocytes (Lymph# 21,15 x 103/µL). Ces constations sont visibles dans le scattergramme WDF, la population de lymphocytes se présentant sous la forme d’un nuage très dense.
Comparés aux réactifs utilisés dans le canal WDF, les réactifs employés dans le canal WPC ont un effet de lyse plus marqué sur les membranes des globules blancs, induisant ainsi une plus grande perméabilité cellulaire. Le marqueur fluorescent spécifique utilisé dans le canal WPC marque l'ADN à l'intérieur du noyau de la cellule. Plus le degré de perméabilisation est élevé, plus le marqueur fluorescent peut pénétrer dans la cellule et se lier à l'ADN, provoquant un signal fluorescent élevé. Les lymphocytes néoplasiques, plus matures, ont des membranes facilement perméables, en raison de la teneur plus élevée en lipides des membranes cellulaires. Elles émettent donc un signal fluorescent élevé. On le remarque sur le scattergramme WPC de la Figure 1 : la population de lymphocytes néoplasiques forme un groupe de points rouges dans la zone fluorescente élevée du scattergramme WPC. La vue SSC-FSC du scattergramme WPC montre deux populations lymphocytaires distinctes (cercles bleus).
Immunophenotyping results interpretation
L'échantillon a été pré-lavé avant la coloration, pour exclure du plasma les immunoglobulines étrangères, qui pourraient affecter les résultats finaux. A la suite de quoi, un protocole de lyse/lavage a été effectué. En bref :
- un cocktail d'anticorps a été placé dans un tube en polystyrène de 75 mm x 12 mm
- Une aliquote de 100 µl de l'échantillon lavé a été prélevée dans le même tube et placée dans un mélangeur à vortex à 2500 tr/min pendant 5 secondes
- Incubation pendant 15 minutes dans l'obscurité à température ambiante
- 2 mL de CyLyse FX dilués 10 fois a été placé dans le tube, pour lyser les globules rouges et fixer les globules blancs, et mélangé avec un vortex de 2500 tr/min pendant 5 secondes
- Incubation pendant 10 minutes dans l'obscurité à température ambiante
- L'échantillon a ensuite été lavé deux fois avec du PBS et placé sur l'XF-1600 pour l’acquisition
Les interactions anticorps/antigène ont lieu dans l'échantillon et le mélange cocktail, de sorte que les anticorps monoclonaux se fixent à l'antigène cible spécifique sur la surface cellulaire. Chaque anticorps monoclonal possède une étiquette fluorescente, que le cytomètre en flux détecte. L'utilisateur est ainsi en mesure de distinguer le positif et le négatif, et donc de poser un diagnostic.
Le CyLyse FX est une solution de lyse à base de formaldéhyde qui lyse les globules rouges et fixe les globules blancs avec l'anticorps et l'étiquette attachés. Sans la lyse, le cytomètre en flux récupérerait également les cellules rouges, non pertinentes pour ce test.
Enfin, l'échantillon est lavé pour exclure les débris de globules rouges de l’acquisition. L’utilisateur dispose ainsi d’une image plus claire lors de l’acquisition de l'échantillon, ce qui assure une analyse précise des données.
Dans ce cas, l'immunophénotypage a révélé une lymphocytose et une faible population à double-positivité CD19/CD5. De plus, une prolifération monoclonale de la chaîne légère lambda a été observée. L'échantillon, négatif à CD10, CD11c et CD38, a également exprimé CD20, CD23 et CD79b, ce qui corrobore le diagnostic d'une B-CLL.
Informations scientifiques
La leucémie lymphoïde chronique (LLC) est un type de lymphome malin. L'OMS classe la LLC dans les lymphomes matures à lymphocytes B, impliquant principalement le sang périphérique, la moelle osseuse ainsi que les ganglions lymphatiques, le foie et la rate [1]. Avec une incidence de 2 à 6 cas pour 100 000 personnes par an dans le monde occidental, c'est la forme de leucémie la plus répandue chez les adultes [2] et le type le plus répandu, en raison de la survie relativement longue du patient [3,4].
L'apparence principalement monomorphique des lymphocytes indique souvent une population cellulaire clonale et néoplasique. Tel qu’observé dans une LLC typique, les lymphocytes anormaux sont généralement de petites cellules d'apparence mature avec une faible activité mitotique [1].
À l'exception des cellules tueuses naturelles (cellules NK), la coloration de Pappenheim ne permet pas de déterminer la lignée des lymphocytes de manière fiable et seules quelques observations d’un point de vue morphologique peuvent être pratiquées. Déterminer les lymphocytes de manière fiable implique de recourir à un immunophénotypage. Les lymphocytes anormaux en cas de LLC expriment les antigènes de surface CD19, CD20, CD5, CD23, CD43 et CD200 avec expression des chaînes légères kappa ou lambda [5]. Le CD10 est négatif.
Références
[1] WHO (2017): Classification of Tumours of Haematopoietic and Lymphoid Tissues. Revised 4th Edition, Volume 2
[2] Rozman C et al. (1995): Chronic lymphocytic leukemia. N Engl J Med. 333(16): 1052-1057.
[3] Lanasa MC et al. (2010): Novel insights into the biology of CLL. Hematology Am Soc Hematol Educ Program. 2010:70-6.
[4] NIH National Cancer Institute (1975-2007): SEER Cancer Statistics Review.
[5] Rawstron AC et al. (2017): Reproducible diagnosis of chronic lymphocytic leukemia by flow cytometry: An European Research Initiative on CLL (ERIC) & European Society for Clinical Cell Analysis (ESCCA) Harmonisation project. Cytometry B Clin Cytom. 94(1): 121-128.
[6] Marionneaux SM et al. (2021): Smudge Cells in Chronic Lymphocytic Leukemia: Pathophysiology, Laboratory Considerations, and Clinical Significance. Lab Med. 52(5): 426-438.
White paper

The white blood cell differential (WDF) channel utilises fluorescence markers that can separate different WBC subtypes according to their cell membrane composition and cytoplasmic content


