Calendrier scientifique - août 2023
Suivi précis du traitement de l’hémophilie
Quel réactif APTT (Activated Partial Thromboplastin Time – temps de thromboplastine partielle activée) ne faut-il pas utiliser pour un suivi de thérapie Esperoct ?
Le choix du réactif APTT n’est en aucune façon limité. N’importe quel réactif, qu’il soit à base de silice, d’acide ellagique ou de kaolin, peut être utilisé pour suivre le traitement par Esperoct.
La plupart des réactifs APTT à base de silice peuvent causer une sous-estimation de la concentration d’Esperoct perfusé. Le choix du réactif APTT dépend donc du produit spécifique.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Contexte
Bien que l’hémophilie en tant que telle soit connue depuis de nombreux siècles et ait été décrite par divers érudits, les traitements efficaces sont relativement récents. Les premières solutions de soin comprenaient uniquement le traitement aigu de l’hémorragie par l’administration de perfusions totales de sang de la famille et, avec la découverte des facteurs de coagulation, l’administration de transfusions de plasma. Ce type de traitement ne pouvait toutefois pas encore prévenir les hémorragies. Cette situation n’a changé qu’à partir des années 1960, lorsque Judith G. Pool découvrit que les cryoprécipités plasmatiques contenaient de grandes quantités de facteur VIII (FVIII). Même si ces cryoprécipités ont continué à être utilisés pour traiter les saignements existants dans les premières années, cette découverte a jeté les bases d’une thérapie préventive, qui sera appliquée pour la première fois avec le développement de concentrés de facteurs recombinants dans la seconde moitié des années 1980. [1, 2]
Ces dernières années, le développement de préparations pour le traitement de l’hémophilie a pris un nouvel élan. Les alternatives thérapeutiques disponibles comprennent aujourd’hui de nouveaux produits recombinants à demi-vie prolongée (EHL – Extended Half-Life) basés sur la modification du facteur de coagulation respectif, la modification du facteur de coagulation par fusion de la région Fc de l’immunoglobuline IgG1 (-Fc) ou de l’albumine, et l’ajout de polyéthylène glycol (PEG) à différents poids moléculaires. [3] Cependant, les stratégies thérapeutiques qui ne visent pas une substitution des facteurs sont aussi de plus en plus répandues. L’Emicizumab est par exemple un anticorps bispécifique monoclonal humanisé pour le traitement de l’hémophilie A (HA). Une extrémité de l’anticorps se lie au facteur de coagulation IX activé (FIXa) et l’autre au facteur de coagulation X (FX). Il imite ainsi la fonction du facteur VIII activé (FVIIIa), qui est absent ou réduit chez les patients soufrant d’hémophilie A (HA). [4] Une autre option pour le traitement des patients hémophiles est la thérapie génique. Ici, une copie entièrement fonctionnelle du gène pour le facteur de coagulation correspondant au gène défectueux de l’hémophilie est introduite dans le corps du patient au moyen de virus génétiquement modifiés (généralement des virus adéno-associés AAV – Adeno-Associated Virus). La traduction du gène dans les cellules endothéliales et les cellules sinusoïdales du foie est stimulée par un promoteur afin que le patient puisse produire idéalement des concentrations suffisantes de facteur de coagulation. [5]
Un suivi fiable et précis du traitement des personnes atteintes d’hémophilie est d’une grande importance pour éviter les saignements indésirables et les séquelles à long terme.
Des tests de coagulation en une et deux étapes ainsi que des tests chromogéniques (CSA – Chromogenic Substrate Assay) sont disponibles pour la détermination des taux de FVIII et de FIX. Les divergences de résultat des différents tests pour l’hémophilie héréditaire sont bien connues, en particulier pour les formes légères. [6, 7, 8, 9, 10] Il en va de même pour les résultats du suivi thérapeutique avec les concentrés de facteur d’origine humaine et les produits recombinants de pleine longueur, même si les tests de coagulation en une seule étape et les tests chromogéniques permettent en fait un suivi thérapeutique précis. Avec le développement de nouveaux facteurs de coagulation recombinants EHL et de ce que l’on appelle les thérapies de remplacement non facteur, de nouveaux défis sont posés pour le laboratoire, qui doit utiliser un test de suivi thérapeutique dont les résultats sont proches de la valeur de traitement calculée sur la base de l’étiquetage du médicament.
Les divergences de résultat des différents tests de facteur en une étape sur base APTT (OSA – One Step APTT) sont attribuées à plusieurs causes. Le choix du réactif APTT servant à déterminer l’activité du facteur doit être pris en compte. Les réactifs APTT se différencient par les phospholipides utilisés (d’origine végétale, animale ou recombinante), par leur concentration, ainsi que par le choix de l’activateur. En outre, le choix du plasma déficient en facteur, par exemple la concentration en facteur de von Willebrand (VWF – Von Willebrand Factor) des plasmas déficients en FVIII ou l’activité résiduelle du facteur dans le plasma déficient, a également une influence critique sur la détermination de la concentration en facteur chez les patients hémophiles. D’autres facteurs pouvant influencer la qualité du suivi du traitement de l’hémophilie sont le choix de l’étalonneur (des étalonneurs spécifiques au test étant recommandés dans certains cas), l’analyseur utilisé, et les protocoles de test (analyse à dilution unique ou analyse à dilutions multiples, linéarité du test). [10, 11, 12]
Comme mentionné précédemment, des divergences existent dans la détermination de l’activité des facteurs entre les tests OSA et CSA lorsqu’ils sont déterminés par ces deux méthodes chez les patients atteints d’hémophilie légère. [6, 7, 8, 9, 10] En général, les résultats du test OSA sont supérieurs à ceux du test CSA, en particulier chez les patients atteints d’HA légère. L’inverse peut toutefois être vrai aussi, où le résultat chromogénique correspond à une hémophilie légère, mais le tableau clinique contredit ce résultat. [13]
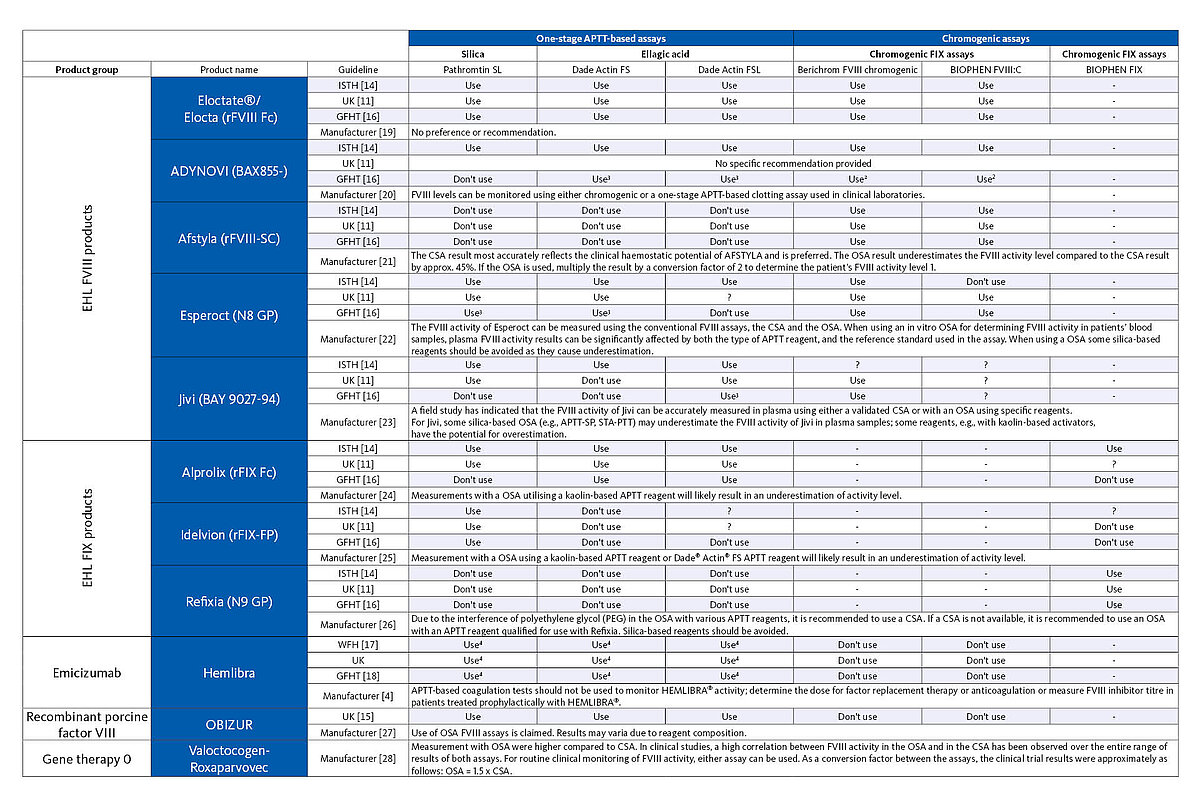
Un autre facteur à ne pas négliger dans le suivi du traitement de l’hémophilie est le médicament lui-même. Pour certains médicaments à EHL, les tests OSA ne sont pas recommandés, car ils sous-estiment l’activité du facteur. Pour d’autres médicaments, cette limitation ne s’applique qu’à l’activateur utilisé par le réactif APTT. Lors de la détermination de la concentration en FVIII perfusé de l’Esperoct (N8 GP) par exemple, la plupart des réactifs APTT à base de silice ne doivent pas être utilisés, car la concentration en FVIII est sous-estimée lors de l’utilisation de ce réactif, ce qui n’est pas le cas avec d’autres réactifs APTT sans silice. Il convient cependant de noter que les directives individuelles excluent également certains réactifs APTT sans silice du suivi thérapeutique de l’Esperoct. Pour d’autres produits recombinants, le choix de la méthode d’analyse n’est pas important, car ils peuvent être mesurés avec précision aussi bien par OSA que par CSA.
Compte tenu du grand nombre d’approches thérapeutiques différentes, il est important que le laboratoire sache quel médicament le patient hémophile a reçu afin de choisir la méthode de mesure la plus appropriée pour le suivi thérapeutique. Le tableau ci-dessous donne un aperçu des systèmes de test qui doivent être utilisés pour le suivi thérapeutique des différentes options de traitement de l’hémophilie, conformément aux instructions du fabricant et à l’avis d’experts.
1 Non recommandé par certaines directives
2 Étalonneur recommandé spécifique au produit
3 Résultats divergents entre les études ; la directive recommande d’utiliser des tests chromogéniques et les résultats doivent être interprétés avec prudence ou comparés aux résultats de tests chromogéniques si un test de facteur APTT en une étape est déterminé
4 Utilisation d’un protocole de test modifié avec une dilution d’échantillon plus élevée et un étalonneur Emicizumab spécifique
? Pas de prise en charge ou d’exclusion spécifiée
Références
[1] Schramm W. (2014): The history of haemophilia - a short review. Thromb Res. 2014 Nov;134 Suppl 1: S4-9.
[2] Franchini M, Mannucci PM. (2014): The history of hemophilia. Semin Thromb Hemost. 2014 Jul;40(5):571-6.
[3] Young G, Mahlangu JN. (2016): Extended half-life clotting factor concentrates: results from published clinical trials. 2016 Jul;22 Suppl 5:25-30.
[4] Hemlibra® (2022): Leitfaden für medizinisches Fachpersonal, Version 3.0, Stand: Dezember 2022. Roche Pharma AG.
[5] ROCTAVIAN (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[6] Bowyer AE, Van Veen JJ, Goodeve AC, Kitchen S, MakrisM. (2013): Specific and global coagulation assays in the diagnosis of discrepant mild hemophilia A. Haematologica 2013;98(12):1980–1987
[7] Baig MA, Swamy KB. (2021): Comparative analysis of chromogenic vs clot-based one stage APTT assay for determination of factor VIII level. Indian J Pathol Microbiol. 2021 Jan-Mar;64(1):123-127.
[8] Potgieter, J.J., Damgaard, M. and Hillarp, A. (2015): One-stage vs. chromogenic assays in haemophilia A. Eur J Haematol, 94: 38-44.
[9] Annette E. Bowyer, Robert C. Gosselin. (2022): Factor VIII and Factor IX Activity Measurements for Hemophilia Diagnosis and Related Treatments. Semin Thromb Hemost, available online at DOI: 10.1055/s-0042-1758870.
[10] Pouplard C, Trossaert M, Le Querrec A, et al. (2009): Influence of source of phospholipids for APTT- based factor IX assays and potential consequences for the diagnosis of mild haemophilia B. Haemophilia. 2009;15(1):365-368.
[11] Gray E, Kitchen S, Bowyer A, et al. (2020): Laboratory measurement of factor replacement therapies in the treatment of congenital haemophilia: A United Kingdom Haemophilia Centre Doctors’ Organisation guideline. Haemophilia. 2020; 26:6–16.
[12] Nougier C, Sobas F, Nguyen TK, et al. (2011): Analytic variability due to change of deficient plasma vials: application to one-stage clotting factor VIII assay. Blood Coagul Fibrinolysis 2011;22: 151–154.
[13] Bowyer AE, Goodeve A, Liesner R,Mumford AD, Kitchen S, Makris M. (2011): p.Tyr365Cys change in factor VIII: haemophilia A, but not as we know it. Br J Haematol 2011;154(5):618–625.
[14] Peyvandi F, et al. (2020): Laboratory testing in hemophilia: Impact of factor and non-factor replacement therapy on coagulation assays. J Thromb Haemost.; 18: 1242–1255.
[15] Bowyer A, Gray E, Lowe A, et al. (2022): Laboratory coagulation tests and recombinant porcine factor VIII: A United Kingdom Haemophilia Centre Doctors’ Organisation guideline. Haemophilia. 2022;1-5.
[16] Jeanpierre E, Pouplard C, Lasne D, et al; On behalf of the French Study Group on the Biology of Hemorrhagic Diseases (the BIMHO group). (2020): Factor VIII and IX assays for post-infusion monitoring in hemophilia patients: Guidelines from the French BIMHO group (GFHT). Eur J Haematol. 2020; 105:103–115.
[17] Srivastava A, et al. (2020): WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia: 26 (Suppl 6): 1 – 158.
[18] Nougier C, et al. (2020): Emicizumab treatment: Impact on coagulation tests and biological monitoring of haemostasis according to clinical situations (BIMHO group proposals). Eur J Haematol.; 105: 675–681.
[19] Elocta (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[20] ADYNOVI (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[21] AFSTYLA (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[22] Esperoct (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[23] Jivi (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[24] Alprolix (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[25] Idelvion (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[26] Refixia (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[27] OBIZUR (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[28] Valoctocogen-Roxaparvovec (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.